|
과학자들이 말하는 ‘늙음’의 진짜 원인(2)
[과학자들이 말하는 ‘늙음’의 진짜 원인] 단백질 항상성 상실, 영양소 감지능력 감소,
미토콘드리아 기능 장애
 ▲ 과학자들은 노화의 원인을 규명하고, 이를 토대로 노화를 막는 치료법을 개발하기 위한 연구를 진행하고 있다. ⓒGettyImages 생물학 분야 최고 권위의 국제학술지 ‘셀(Cell)’은 2013년 ‘노화의 특징(The Hallmarks of Aging)’이라는 제목의 논문을 발표하며 생물학적 노화의 9가지 특징을 정리했다. 이후 10년간 추가된 연구를 종합하여 지난 1월 ‘노화의 특징: 확장판’을 다시 펴냈다. 사이언스타임즈는 지난 기사(관련 기사 보러 가기 ? 과학자들이 말하는 ‘늙음’의 진짜 원인_1편)에 이어서 노화의 생물학적 특징을 소개해보고자 한다. 노화의 원인 4: 단백질 항상성 상실 ▲ 단백질이 정상적인 형태와 구조를 이루도록 돕는 ‘샤페론 단백질’의 구조 ⓒWikipedia 우리 몸속 단백질의 종류는 10만 종이 넘고, 무게로는 체중의 20% 정도다. 필요한 단백질은 새로 합성되고, 불필요하거나 변성된 단백질은 분해된다. 평균적으로 단백체(생체에 있는 단백질의 총집합)의 2~3%가 매일 교체된다. 단백질이 새로 합성되고, 활동하고, 분해되는 일련의 과정을 단백질 항상성이라고 한다. 즉, 문제가 있는 단백질의 세포 내 축적을 막고, 세포 내 단백질들을 지속해서 새로운 것으로 갱신시키는 과정이다. 하지만 노화에 따라 단백질 항상성은 떨어진다. 젊을 때는 피부에 생채기가 나도 빨리 회복되지만, 나이가 들수록 상처가 빨리 아물지 않는 것도 항상성과 깊은 관련이 있다. 단백질의 일생을 조금 더 자세히 설명해보겠다. 우선, 단백질이 정상적인 구조와 형태를 이루도록 ‘샤페론’이라는 단백질이 세포에서 활동한다. 불안정한 단백질이 생기면 그 구조가 안정되도록 도와주는 역할이다. 그러나 단백질이 잘못 만들어지면 빠르게 분쇄하여 배설되거나 재활용된다. 분해되는 방법은 두 가진데 ‘유비퀴틴’이라는 효소를 통해 하나하나의 단백질을 선별하는 과정과, ‘자가 포식’이라는 통해 제 기능을 하지 못하는 여러 단백질을 한꺼번에 포장하여 분해하는 방법이 있다. 노화에 따라 이 기능들은 모두 감소하기 때문에 손상된 단백질이 제거되지 못하고 쌓이면, 세포 분화를 방해하고 염증 및 세포 노화를 유발한다. 변성 단백질의 축적은 보통 나이에 비례하는데, 파킨슨병, 알츠하이머, 당뇨병 등 노화 관련 질병의 원인이 된다. 노화의 원인 5: 거대 자가 포식 장애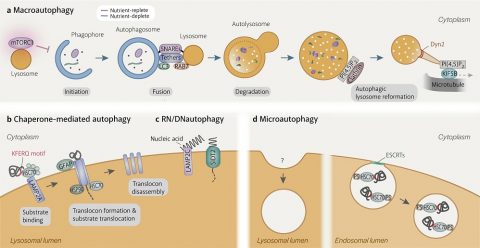 ▲ 자가 포식은 세포 내 불필요하거나 기능이 고장 난 세포소기관을 분해하는 메커니즘으로 크게 거대 자가 포식(a), 샤페론 매개 자가 포식(b), 미세 자가 포식(c)으로 나뉜다. 노화에 따라 자가 포식 기능이 떨어지고, 이 때문에 노화 관련 질병이 유발된다. ⓒCell Discovery 앞서 살펴본 것처럼, 자가 포식은 세포가 제 몸 일부를 스스로 잡아먹는 현상을 말한다. 그래서 자가 포식이라는 단어도 ‘스스로(auto)’와 ‘섭취(phagy)’를 뜻하는 그리스어를 합쳐 만들어졌다. 이 현상을 처음 발견한 오스미 요시노리 일본 도쿄공업대 명예교수는 지난 2016년 노벨 생리의학상을 수상하기도 했다. 거대 자가 포식 장애는 올해 ‘노화의 특징: 확장판’에 새롭게 추가된 원인이다. 그중에서도 거대 자가 포식(macroautophagy)는 자가 포식의 주된 유형으로, 단백질, 지방 및 세포 소기관을 포함한 세포 내용물을 리소좀 속에서 소화하는 과정이다. 망가진 물질만 분해하는 것은 아니다. 외부에서 영양소 공급이 끊기면 정상적인 제 몸의 일부마저 분해해 생존에 필요한 영양소로 사용한다. 다이어트 방법으로 거론되는 ‘간헐적 단식’은 이러한 자가 포식 작용을 근거로 사용한다. 여러 연구를 통해 노화가 진행되며 조직의 자가 포식 정도가 점차 줄어든다는 것이 확인됐다. 장수하는 쥐를 살펴보니 자가 포식이 활발하다는 결과도 있다. 또한, 자가 포식에 결함이 생기면 암, 심장병, 퇴행성 뇌 질환 같은 노화 관련 질병 발생에 직접적인 영향을 준다. 노화의 원인 6: 영양소 감지능력 저하 ▲ 외부에서 흡수된 영양소의 정상 범위 농도를 인지하는 감지능력 저하도 노화의 대표적인 특징이다. ⓒGettyImages 인슐린을 감지하면 세포는 포도당을 내부로 받아들여 혈당을 떨어뜨린다. 외부에서 흡수된 영양소에 대해 정상 범위의 농도를 인지하고 반응하는데, 노화가 진행되면 영양소 감지능력이 저하되며 적절한 대응을 하지 못한다. 즉, 영양소를 감지하는 능력이 둔해지는 것이다. 영양소 감지 능력이 떨어지면, 에너지를 만드는 미토콘드리아의 기능 감소를 유발해 세포의 노화가 촉진된다. 하지만 모순적이게도 영양소 감지 능력을 인위적으로 저하하면 오히려 수명을 연장할 수 있다는 가능성이 제시됐다. 성장호르몬과 인슐린과 유사한 분자구조를 가진 신진대사에 관여하는 호르몬인 인슐린 유사성장인자(IGF)는 나이가 듦에 따라 감소한다. 하지만 동물실험에서 유전자 조작을 통해 이들 수치를 인위적으로 낮추자, 세포 성장과 대사작용이 최소화하는 방어기제가 발동한 것이다. 이처럼 영양소 감지능력 저하는 노화된 개체의 공통적인 특징이지만, 오히려 노화를 막는 항노화 치료의 방법이 되기도 한다. 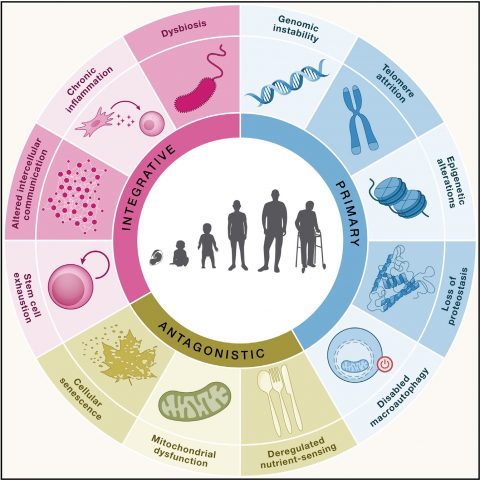 ▲ 2023년 국제학술지 ‘Cell’이 제시한 노화의 12가지 특징. 이번 기사에서는 단백질 항상성 상실(Loss of proteostasis), 거대 자가 포식 장애(Disabled macroautophagy), 영양소 감지능력 저하(Deregulated nutrient-sensing)에 대해 다뤘다. ⓒCell
|